Molekularno slikanje v celici
Oznaka in naziv projekta
J7-9398 Molekularno slikanje v celici
J7-9398 Molecular imaging inside the cell
Logotipi ARRS in drugih sofinancerjev

Projektna skupina
Vodja projekta: prof. dr. Primož Pelicon
Sodelujoče raziskovalne organizacije: Povezava na SICRIS
Sestava projektne skupine: Povezava na SICRIS
Vsebinski opis projekta
»Slikovna masna spektrometrija (angl. Imaging Mass Spectrometry , IMS) omogoča vpogled v biokemijske procese s slikanjem molekularnih porazdelitev v bioloških tkivih, s čimer nudi vizualizacijo kompleksnih fizioloških procesov. Razpoložljive tehnologije IMS se soočajo s fizikalnimi omejitvami za slikanje molekularnih porazdelitev na subcelularni ravni, saj fizikalni procesi za ekstrahiranje biomolekul iz vzorca bodisi uničijo šibke vezi biomolekul ali ne zmorejo ekstrahirati biomolekul z dovolj majhnega območja na vzorcu. Projekt MICE (Molekularno slikanje znotraj celice, angl. Molecular Imaging Inside The Cell, MICE) razvija novo tehnologijo IMS, ki združuje znanje fizike, biomedicine in inženirstva. Za mehanizem molekularnega slikanja uporabljamo proces sekundarne ionske emisije molekularnih ionov , ki jih desorbirajo težki ioni energij MeV s površine bioloških tkiv. Nastajajoča tehnologija IMS nosi akronim MeV-SIMS (Sekundarna ionska masna spektrometrija z ioni energije MeV).
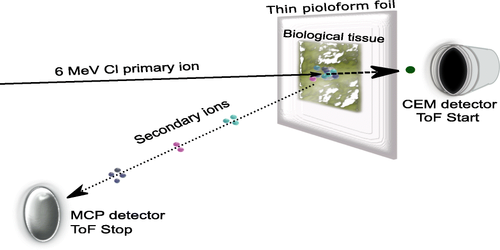
Slika 1: MeV-SIMS s kontinuiranim primarnim žarkom (Vir: Jenčič et al, JASMS 2019).
Osnovni podatki sofinanciranja so dostopni na spletni strani. Povezava na SICRIS.
Podrobnejši opis projekta
Projekt MICE (Angl. Molecular Imaging inside the Cell) (ARRS J7-9398) sestavljajo štirje delovni paketi z nizom nalog:
DP1: Izboljšanje lateralne ločljivosti od 10 μm do 500 nm (N1: obdelava tkiva za subcelularno IMS s kontinuirnim snopom, N2: oblikovanje hitrega ionskega žarka 500 nm, N3: novo zaporedje slikanja TOF: začetek primarnih ionov ) • DP2: Slikanje intracelularne biokemije (N1: slikanje poti ekspresije genov v rastlinskih celicah, N2: odziv v celicah na sintetične spojine in uporaba v zdravilih). • DP3: Izboljšanje masne spektrometrije (N1: nadgradnja masnega spektrometra TOF: od linearnega TOF do odbojnika. N2: nadgradnja elektronike FPGA: ločljivost od 4 ns do 300 ps) • DP4: Razširjanje informacij o tehnologiji, izkoriščanje, diseminacija (N1: dostop do nove tehnologije IMS, N2: industrijske aplikacije, razširjanje, izkoriščanje)
Po izteku 22 mesecev projekta (od skupaj 36 mesecev, status na dan 1.5.2020) je na Delovnih paketih projekta opravljeno veliko predvidenega dela. Doseženi so mnogi predvideni cilji, nekatere od nalog pa še potekajo:
DP1: N1: Spremenili smo postopek obdelave tkiva za MeV-SIMS, ki je prej za debele rezine biološkega tkiva v osnovi uporabljalo rešitve za klasični SIMS. Da lahko detektiramo primarne ione po zadetku tkivnega vzorca, morajo biti tkivne rezine mnogo tanjše. Na kriotomu smo rezali rezine zamrznjenega hidriranega tkiva v obliki vitrificiranega ledu debeline reda 10 mikrometrov, jih odložili na prevodno ultra-tanko polimerno membrano debeline 100 nm s prevodno površino, in jih liofilizirali. Tako smo po odstranitvi vode z liofilizacijo ustvarili vzorce suhega tkiva z debelino velikostnega reda 4 mikrometre, ki omogoča prehod ionov klora z energijo 6 MeV. Na tak način smo pripravljali vzorce različnih rastlinskih in živalskih tkiv. N2: Priprava težkih visokoenergijskih žarkov za MeV-SIMS, npr. ionskega žarka 35Cl6+ (klorovi ioni z nabojem 5+) in energijo 5 MeV, poteka v odprševalnem ionskem izvoru, ki ima omejeno svetlost. Da bi s takim žarkom dosegli premer manjši od enega mikrometra, je potrebno zelo zapreti objektno in kolimatorsko režo na žarkovni liniji z ionskim mikrožarkom. To povzroči padec ionskega toka za pet redov velikosti, z 109 ionov/sek na 104 ionov/sek. Premer žarka smo merili s premikanjem žarka čez kalibracijsko mrežico, pri tem pa optimizirali nastavitve na ionski optiki. Pri ionskem toku 5000 ions/sek smo dosegli premer žarka 800 nanometrov. N3: Pri tako nizkih intenzitetah ionskega žarka je potrebno vsakega od ionov uporabiti za desorpcijo sekundarnih ionov, da zaznamo masne spektre z dobro statistiko. V prej uporabljenem načinu merjenja MeV-SIMS smo primarni žarek pulzirali s hitrimi elektrostatskimi odklonilniki v žarkovni liniji. To povzroči močno izgubo ionskega toka primarnih ionov, zato v našem primeru že tako nizkega primarnega fluksa ne bi delovalo. Namesto tega smo za vzorec instalirali enokanalni elektronski pomnoževalec (angl. Continuous electron multiplier, channeltron), ki zazna vsak posamezni primarni ion po prehodu vzorca. Merjenja časa preleta (angl. Time-Of-Flight, TOF) tako prožimo (TOF Start) ob detekciji primarnega iona, ki preleti vzorec. Uro ustavimo, ko sekundarni ioni preletijo razdaljo v masnem spektrometru in zadenejo mikrokanalno ploščico detektorja (TOF Stop). Definicija pulza “TOF Start” je v tem primeru izredno natančna v času, saj je določena s tipično razmazanostjo 1 nanosekunde. To močno izboljša doseženo masno ločljivost v izmerjenem masnem spektru.
DP2: N1: Delo na področju rastlinske biologije z MeV-SIMS poteka vzporedno z razvojem metode, pri tem pa uporabljamo zadnjo doseženo stopnjo izboljšav. MeV-SIMS uporabljamo za detekcijo in meritve lateralnih porazdelitev sekundarnih metabolitov v tkivu. Zelo natančno smo v zadnjem letu preučevali rastlino ajdo, ki je lokalno pomemna kot živilo, hkrati pa kandidat za t.i. “superhrano”, saj določene sorte/vrste vsebujejo visoke vrednosti antioksidantov. Posvetili smo se meritvi molekularnih zemljevidov rutina in kvercitina v zrnu navadne in tatarske ajde, in s tem podprli strategije mletja in ločevanja frakcij moke. N2: Penetracija pesticidov v pridelke je zelo aktualna in hkrati pomemna problematika pridelave hrane. V prvem koraku smo se posvetili interakciji herbicida glifosata s koruzo. Tkivo tretiranega zrna koruze smo merili z lateralno ločljivostjo 800 nanometrov. Prvi rezultati kažejo visoko lateralno ločljivost metode, saj so jasno vidne posamezne celice, in kažejo na povišane koncentracije glifosata na površini zrn.
DP3: N1: Intenzivno smo preučili možnosti povečanja ločljivosti masnega spektrometra TOF s podaljšanjem poti preleta in dodatkom reflektronske stopnje. V letu 2019 smo izvedli javni razpis in v začetku 2020 prejeli reflektronsko stopnjo masnega spektrometra. Instalacija zahteva dodatno delo v mehanskih delavnicah IJS in je v teku. N2: Popolnoma smo prenovili sistem za zajem podatkov na postaji z viskoenergijskim fokusiranim ionskim žarkom. Koncept posodobitve je potekal v drugi polovici 2019 in v začetku 2020. V januarju 2020 smo skupaj z inženirjem dobavitelja instalirali nova akvizicijsko strojno in programsko opremo. V akvizicijski sistem za mapiranje smo integrirali ultrahitri časovno-digitalni pretvornik (TDC) s časovno ločljivostjo 250 pikosekund (0.25 nanosekunde). V februarju 2020 smo verificirali delovanje hitrega TDC za potrebe MeV-SIMS.
DP3, dodatne aktivnosti: Izkoristek detektorja sekundarnih ionov z mikrokanalno ploščico za sekundarne molekularne ione z mason ad 100 Da in energijo 3 keV je zelo nizek (pod 5 %), to pa zelo znižuje občutljivost za najbolj zanimive težke organske molekule. Da bi izboljšali izkoristek in s tem občutljivost za detekcijo velikih organskih molekul z maso nad 3 kDa, smo preučili možne eksperimentalne pristope s post-akceleracijo in z alternativnimi tipi detektorjev za sekundarne ione. Na koncu smo se odločili za nabavo in instalacijo detektorja z diskretnimi anodami in post-akceleracijo z napetostjo 10 keV. Testiranje sistema bo potekalo vzporedno z instalacijo reflektronske stopnje.
DP4: N1: MeV-SIMS smo v obstoječem obratovalnem stanju vključili v program mednarodnega dostopa raziskovalcev (angl. Transnational Access, TNA), ki ga financira EU. Tako je MeV-SIMS na pospeševalniku IJS že na voljo za TNA v okviru infrastrukturnega projekta EU v okviru projekta H2020 “Radiate” (No. 824096, https://www.ionbeamcenters.eu/radiate/). Hkrati je tehnika MeV-SIMS vključena med instrumentacijo lokalnega vozlišča SimBion, ki se je pravkar formalno vključil v ESFRI (ERIC) projekt distribuirane evropske raziskovalne infrastrukture Euro-BioImaging . N2: Komunikacija s potencialnimi uporabniki metode MeV-SIMS iz raziskav in industrije intenzivno poteka. Tik pred izbruhom pandemije smo imeli sestanek s skupino iz tujine, ki bi merila penetracijo skladiščnih pesticidov v kmetijske pridelke.
Projektne reference
DP1, DP2:
Boštjan Jenčič, Primož Vavpetič, Mitja Kelemen, Matjaž Vencelj, Katarina Vogel-Mikuš, Anja Kavčič, Primož Pelicon, MeV-SIMS TOF Imaging of Organic Tissue with Continuous Primary Beam, Journal of the American Society for Mass Spectrometry 30 (2019) 1801-1812. https://doi.org/10.1007/s13361-019-02258-8
DP1, DP3:
Boštjan Jenčič, Primož Vavpetič, Mitja Kelemen, Primož Pelicon, Secondary Ion Yield and Fragmentation of Biological Molecules by Employing 35Cl Primary Ions within the MeV Energy Domain, Journal of the American Society for Mass Spectrometry 31 (2020) 117-123. https://doi.org/10.1021/jasms.9b00019
DP4:
S. Hoereth et al, Arabidopsis halleri shows hyperbioindicator behaviour for Pb and leaf Pb accumulation spatially separated from Zn, New Phytologist 226 (2020) 492–506. https://doi.org/10.1111/nph.16373
P. Pongrac et al, Contrasting allocation of magnesium, calcium and manganese in leaves of tea (Camellia sinensis (L.) Kuntze) plants may explain their different extraction efficiency into tea, Food and Chemical Toxicology 135 (2020) 110974. https://doi.org/10.1016/j.fct.2019.110974
Malay et al, An ultra-stable gold-coordinated protein cage displaying reversible assembly, Nature 569 (2019) 439. https://doi.org/10.1038/s41586-019-1185-4