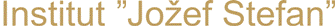RAZISKOVALNO DELO
Raziskovalni program
Heterogena kataliza
Adsorpcija in razpad didušikovega oksida (N2O) na površinah Pd(110) in Rh(110): razpad molekule N2O na površinah rodija in paladija je pomemben pri katalitičnem odstranjevanju dušikovih oksidov, prisotnih v izpušnih plinih, saj se te kovine uporabljajo kot aktivne sestavine tripotnih avtomobilskih katalizatorjev. V okviru te študije želimo ugotoviti mehanizem zanimive dvosmerne poševne desorpcije dušika N2 pri termičnem razpadu N2O na omenjenih povšinah.
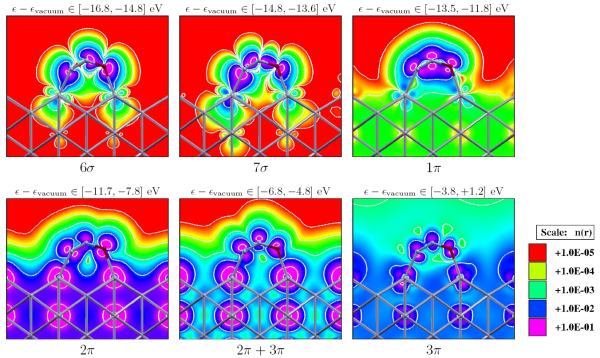
Adsorpcija etena (C2H4) na površinah srebra: epoksidacija etena je ena izmed najbolj pomembnih heterogenih katalitičnih selektivnih oksidacij. Srebro ima edinstvene katalične lastnosti za omenjeno reakcijo. Etenov epoksid (oksiran) se v industriji uporablja pri proizvodnji poliolov in glikolov. S simulacijami smo raziskali vpliv površinskih nepravilnosti pri adsorpciji etena na omenjeni površini in ugotovili, da so manj koordinirani površinski atomi v bližini nepravilnosti znatno bolj reaktivni, zato se eten preferenčno veže na površino na mestih, kjer so nepravilnosti. Raziskali smo tudi vpliv adsorbiranega kisika pri omenjenem procesu in ugotovili, da atomarni kisik, adsorbiran na površino, ne spremeni bistveno adsorpcijske lastnosti površine. Nasprotno pa atomarni kisik, adsorbiran na t. i. podpovršinska mesta poveča reaktivnost površine.
Dehidrogenacija metana (CH4) na površinah kovin prehoda: metan je osnovna komponenta naravnega plina, in zato je pomemben vir pri proizvodnji energije in kemikalij. Zaradi plinskega agregatnega stanja metan ni primeren za transportiranje, zato bi ga bilo zaželeno kemično spremeniti v tekočino, npr. v metanol (CH3OH). Problem pri heterogeni katalitični pretvorbi metana (npr. v metanol) je, da je aktivacijska pregrada za prvo stopnjo dehidrogenacije CH4→CH3+H višja kot za nadaljnje stopnje. Zaradi tega se tvori grafit na katalizatorju, ki le-tega deaktivira. S simulacijami skušamo razumeti, kako je mogoče znižati aktivacijsko pregrado za prvo stopnjo dehidrogenacije CH4→CH3+H in ne bistveno znižati ali celo zvišati aktivacijsko pregrado za naslednjo stopnjo CH3→CH2+H.